퇴행성 시신경 질환 발생 원인되는 단백질 규명...“시신경세포 사멸 지연방법 발견”
시신경이 사멸돼 결국 실명이 되는 중증 질환에 큰 도움을 줄 수 있는 방안이 제주대 연구팀에 의해 밝혀졌다.
10일 교육부에 따르면 제주대 아열대원예산업연구소 이종우 교수 연구팀이 시신경의 초파리의 단백질 연구를 통해 시력 상실을 늦출 수 있는 기제를 밝혀냈다.
이 교수팀은 초파리의 시신경에서 로돕신 리싸이클링이 원활히 일어나도록 도와주는 새로운 유전자 ‘다이하드4’를 밝혀냈다. 로돕신은 시신경 세포막에 존재하는 단백질로 명암과 같은 시각정보를 전기적 신호로 바꿔주는 단백질 결합수용체다.
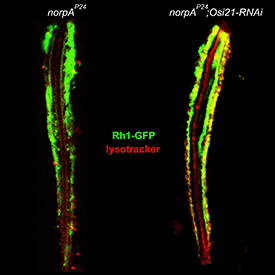
연구팀은 로돕신이 시신경세포 내에 축적돼 겹눈구조가 망가진 초파리에서 다이하드4가 만들어지지 않도록 하면 시신경세포 사멸이 지연되는 것을 발견했다. 시력 상실을 늦출 수 있는 방법이 발견된 것이다.
로돕신이 쌓이면 시신경 질환이 일어나는데, 이 로돕신을 막는 방법이 다이하드4의 생산을 억제하면 된다는 것.
시신경 세포막에 있는 로돕신은 빛에 의해 활성화된 후 재빠르게 활성이 억제돼야 명암을 잘 구분할 수 있다. 때문에 역할을 다한 로돕신은 세포내로 흡입되면서 만들어지는 주머니인 엔도좀에 머물다가 재생과정을 통해 원래 있던 세포막으로 돌아가거나 세포내 쓰레기 처리장인 리소좀으로 이동해 분해된다.
그러나 이러한 순환과정이 원활하지 못하면 엔도좀에 로돕신이 쌓이게 되고 세포에 부담을 주어 망막색소변성증과 같은 퇴행성 시신경 질환을 일으킨다.
반면 다이하드4가 만들어지지 않으면 세포 내 로돕신이 축적되는 장소인 후기엔도좀이 크게 감소하고 리소좀이 증가했다. 또 리소좀으로의 로돕신 수송이 촉진되어 로돕신의 엔도좀 내 축적이 해소되는 것으로 나타났다.
이종우 교수는 “이번 연구결과로 G-단백질 결합 수용체의 비정상적인 활성억제 과정으로 야기되는 퇴행성 신경질환과 관련한 신약 개발의 새로운 타겟을 제공해 줄 수 있을 것”고 밝혔다.
한국연구재단은 이번 연구로 시각정보를 전달하는데 핵심적인 역할을 하는 로돕신의 재생과 분해를 조절하는 단백질의 정체가 파악돼 향후 퇴행성 시신경 질환의 발병기전 연구에 기여할 것으로 보고 있다.
이번 연구는 교육부와 한국연구재단이 추진하는 일반연구자지원사업의 지원으로 수행됐다.
성과가 정리된 논문은 유전학 분야의 국제학술지 플로스 제네틱스(PLoS Genetics) 6월 6일자 온라인 판에 게재됐다.

<제주의소리>
<문준영 기자 / 저작권자ⓒ제주의소리. 무단전재_재배포 금지>

